Unique Device Identification System (System zur eindeutigen Identifizierung von Medizinprodukten) – Teil 1
In verschiedenen auf Medizinprodukte bezogenen Rechtsordnungen weltweit wird das System zur eindeutigen Identifizierung von Medizinprodukten (Unique Device Identification, UDI) entwickelt, um eine angemessene Identifizierung von Medizinprodukten während des Vertriebs und der Verwendung zu ermöglichen. Gesundheitsdienstleister, Vertriebspartner, Einkaufsgemeinschaften, Kostenträger, Forscher und andere nutzen UDI für die Effizienz der Lieferkette, die Nachverfolgung von Medizinprodukten in der elektronischen Gesundheitsakte, einschließlich Track & Trace, vergleichende Wirksamkeitsforschung, elektronische Beschaffung und eine Vielzahl anderer Informationen. Dieser Artikel, der erste in einer zweiteiligen Serie, gibt Ihnen einen kurzen Überblick über die Grundlagen des UDI und seine Bedeutung für den Track-&-Trace-Prozess in Medizinprodukteunternehmen. In diesem Teil wollen wir die Grundlagen besprechen, einschließlich der Frage, was UDI ist und warum es wichtig ist.
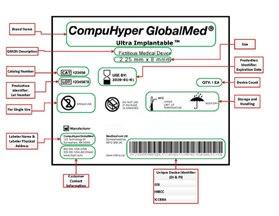
Was ist ein UDI-System? Ein System zur eindeutigen Identifizierung von Medizinprodukten soll eine einzige, weltweit harmonisierte positive Identifizierung von Medizinprodukten während ihres Vertriebs und ihrer Verwendung ermöglichen, wobei das Produktetikett eine weltweit eindeutige Produktkennzeichnung tragen muss, die mit Hilfe der automatischen Identifizierung und Datenerfassung und gegebenenfalls ihrer auf Standards basierenden menschenlesbaren Interpretation übermittelt wird, wobei die UDI-Produktkennung (Device Identifier, DI) dieser eindeutigen Kennung auch mit einer rechtsordnungsspezifischen öffentlichen UDI-Datenbank abgeglichen wird.

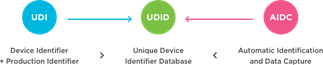
Komponenten eines UDI-Systems: Ein grundlegendes UDI-System umfasst zwei numerische oder alphanumerische Kennungen – Produktkennung (UDI-DI) und Produktionskennung (UDI-PI).
-
Eine Produktkennung (DI) ist ein obligatorischer, fester Bestandteil eines UDI-Systems, der die spezifische Produkt-/Verpackungskonfiguration eines Herstellers identifiziert und als „Zugangsschlüssel“ zu den in einer UDI-Datenbank gespeicherten Informationen dient. Verschiedene UDI-ausstellende Stellen haben ihre eigenen Konfigurationen von Produktkennungen (d. h., UDI-DI kann die GS1 GTIN oder Global Trade Item Number, HIBC-UPN oder die Universal Product Number oder ICCBBA ISBT 128-PPIC oder Processor Product Identification Code enthalten).
-
Eine Produktionskennung (Production Identifier, PI) ist ein Code, der die Einheit der Geräteproduktion identifiziert und die Los- oder Chargennummer, die Seriennummer, das Verfallsdatum, das Herstellungsdatum und/oder die Version für Software eines Medizinprodukts (Software of a Medical Device, SaMD) usw. enthält.
Vorteile eines UDI-Systems für Medizinprodukte: Das UDI-System bietet eine Reihe von Vorteilen für die Industrie, einschließlich Aufsichtsbehörden, Verbraucher, Gesundheitsdienstleister und Gesundheitssystemen, indem es Folgendes ermöglicht:
-
Schnellere Entdeckung von fehlerhaften Medizinprodukten
-
Schnellere Rückrufe von fehlerhaften Medizinprodukten
-
Verringerung medizinischer Fehler durch Angehörige der Gesundheitsberufe
-
Eindämmung von Produktfälschungen
-
Besser begründete Patientenbehandlung
-
Bessere Bewertung von Produktleistungen
-
Verbesserte Bestandsverwaltung
-
Ärzte, die mehr Zeit für die Patienten haben
-
Ein weltweites System zur Identifizierung von Medizinprodukten
Ich wette, Sie sind neugierig darauf, mehr über die Mechanismen und Auswirkungen von UDI zu erfahren. Bleiben Sie dran für den zweiten Teil, in dem wir versuchen werden, mehr über diese Themen zu vermitteln.
Bildquelle: Die US-amerikanische Food and Drug Administration (FDA)



